อะตอมและสมบัติของธาตุ
2.1 แบบจำลองอะตอม
-แบบจำลองอะตอมของ ดอลตัน (1808)-แบบจำลองอะตอมของ ทอมสัน (1904)
-แบบจำลองอะตอมของ รัทเธอร์ฟอร์ด (1911)
-แบบจำลองอะตอมของ โบร์ (1913)
-แบบจำลองอะตอม กลศาสตร์ควอนตัม(กลุ่มหมอก) (1926-ปัจจุบัน)
สรุปแนวคิดของ จอห์น ดอลตัน
1.สสารประกอบขึ้นจากอนุภาคที่เล็กที่สุด เรียกว่าอะตอม มีลักษณะเป็นทรงกลมตันที่ไม่สามารถแบ่งแยกได้อีก
2.อะตอมไม่สามารถสร้างขึ้นใหม่ หรือทำลายได้
3.อะตอมของธาตุชนิดเดียวกัน จะมีคุณสมบัติเหมือนกัน
3.1 ในทางกลับกันอะตอมของธาตุต่างชนิดกัน จะมีสมบัติต่างกัน
4.เมื่ออะตอมของธาตุต่างชนิดกันมารวมตัวกัน จะเกิดเป็นสารประกอบ
4.1 โดยสารประกอบจะมีอัตราส่วนของธาตุเป็นเลขลงตัวจำนวนต่ำๆ
สรุปแนวคิดของ ทอมสัน
1.อะตอมเป็นทรงกลมที่เป็นกลางทางไฟฟ้า ซึ่งประกอบขึ้นด้วยอนุภาคที่มีประจุบวกและอนุภาคที่มีประจุลบ ซึ่งมีค่าประจุไฟฟ้าเท่ากัน
2.ประจุบวกและประจุลบของอะตอมจะกระจายตัวอยู่ทั่วทั้งอะตอมอย่างสม่ำเสมอ โดยประจุลบจะฝังตัวอยู่ในเนื้ออะตอมที่มีประจุบวก
สรุปแนวคิดของ รัทเธอร์ฟอร์ด
1.ภายในอะตอมเป็นพื้นที่ว่างเป็นส่วนใหญ่
2.เนื่องจากโปรตอนซึ่งมีประจุเป็นบวกนั้นรวมตัวกันอย่างหนาแน่นอยู่ตรงกลางของอะตอม เรียกกว่านิวเคลียส
3.นิวเคลียสของอะตอมนั้นมีขนาดเล็กมากเมื่อเทียบกับขนาดทั้งหมดของอะตอม ถึงแม้ว่านิวเคลียสจะมีขนาดเล็กแต่ก็มีมวลสูงมาก
4.อิเล็กตรอนเคลื่อนที่อยู่รอบๆนิวเคลียส และเคลื่อนที่เป็นบริเวณกว้าง
สรุปแนวคิดของ โบร์
1.อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสเป็นวงโคจร โดยมีขนาด และค่าพลังงานที่แน่นอน
2.ขนาดวงโคจรของอิเล็กตรอนนั้นจะสำพันธ์กับระดับพลังงาน
2.1 ที่ระดับพลังงานต่ำ วงโคจรจะมีขนาดเล็ก และอยู่ใกล้กับนิวเคลียส
2.2 เมื่อระดับพลังงานเพิ่มขึ้น วงโคจรจะมีขนาดใหญ่ขึ้น และอยู่ห่างจากนิวเคลียสมากขึ้น
3.อิเล็กตรอนสามารถเคลื่อนที่ข้ามจากระดับพลังงานหนึ่งไปยังระดับพลังงานหนึ่งได้ เมื่อมีได้รับหรือสูญเสียพลังงาน
3.1 เมื่อได้รับพลังงานจะอิเล็กตรอนจะข้ามขึ้นไปยังระดับพลังงานที่สูงขึ้น(ไกลจากนิวเคลียส)
3.2 เมื่อสูญเสียพลังงานอิเล็กตรอนจะข้ามลงมายังระดับพลังงานที่ต่ำลง (เข้าใกล้นิวเคลียส)
สรุปแนวคิดทาง กลศาสตร์ควอนตัม
1.อิเล็กตรอนมีสมบัติเป็นทั้งอนุภาคและคลื่น ทำให้ไม่สามารถระบุตำแหน่งที่แน่นอนของอิเล็กตรอนได้
2.แต่สามารถระบุได้ว่าบริเวณใดที่มีโอกาศพบอิเล็กตรอน
3.อิเล็กตรอนเคลื่อนที่อยู่รอบๆนิวเคลียสในลักษณะของกลุ่มหมอกที่มีประจุเป็นลบ
3.1 ยิ่งเข้าใกล้นิวเคลียสโอกาศที่พบอิเล็กตรอนยิ่งสูงขึ้น
4.กลุ่มหมอกหรือบริเวณที่มีโอกาศพบอิเล็กตรอน เรียกว่า ออร์บิทัล
4.1 ออร์บิทัลมีหลายรูปแบบ เช่น s, p, d และ f
2.2 อนุภาคในอะตอมและไอโซโทป
ในหัวข้อที่ผ่านมานักเรียนได้ทราบแล้วว่าทอมสันค้นพบอิเล็กตรอนและค่าประจุต่อมวลในหัวข้อนี้นักเรียนจะได้รู้ เกี่ยวกับอนุภาคชนิดอื่นที่เป็นองค์ประกอบของอะตอม
2.2.1 อนุภาคในอะตอม
ในปีพ.ศ 2451 โรเบิร์ตแอนดรูส์มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยการอาศัยสังเกตหยดน้ำมันในสนามไฟฟ้าดังรูป
เมื่อโลหะ ทำปฏิกิริยากับอโลหะอะตอมของโลหะจะเสียเวลาแต่เล็กจนกลายเป็นไอออนบวกจำนวนอิเล็กตรอนในอะตอมจึงลดลงทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วยหรือกล่าวอีกนัยหนึ่งก็คือแรงดึงดูดระหว่าง ประจุในนิวเคลียสกับอิเล็กตรอนจากเพิ่มมากขึ้น Iron ห่วงจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบเนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิมไอออนลบจึงมีขนาดใหญ่กว่าอะตอมเดิม ดังรูป
2.4.5 พลังงานไอออไนเซชัน
2.4.6 สัมพรรคภาพอิเล็กตรอน
พลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอนเลขว่าสัมพรรคภาพอิเล็กตรอนเขียนสมการการเปลี่ยนแปลงได้ดังนี้
A(g) + e^- ---> A^-(g)
หาค่าสัมพรรคภาพอิเล็กตรอน มีค่าเป็นบวกหมายความว่าอะตอมคายพลังงานเมื่อได้รับอิเล็กตรอนแสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดี ถ้าค่าสัมพรรคภาพอิเล็กตรอนเป็นลบแปลว่าต้องใช้พลังงานเพิ่มเข้าไปเพื่อให้และรับอิเล็กตรอนได้เพิ่มขึ้น 1 อิเล็กตรอน เมื่อพิจารณาตามข้อพบว่าค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะยกเว้น หมู่ VIIIA มีค่ามากกว่าธาตุโลหะแสดงว่าธาตุอโลหะมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดีกว่าถ้าโลหะเมื่อพิจารณาโดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มในการรับอิเล็กตรอนได้ดีกว่าท่านผู้อื่นที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่นี้จะทำให้มีอะตอมที่มีการจัดเรียงอิเล็กตรอนของธาตุหมู่ VIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตีความสามารถของอะตอมในการดึงดูดอีเล็คตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสารแนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางเป็นดังนี้
เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอมเนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุดและหมู่ VIIA มีขนาดเล็กที่สุด ความสามารถในการดึงดูดอีเล็คตรอนตามข้ามจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุดควรธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุดธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตี ลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดของอะตอมที่เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง
เนื่องจากสัญลักษณ์รังสีดังรูปสื่อความหมายไม่ได้ชัดเจนหรือบุคคลที่ไม่เกี่ยวข้องอ่านไม่เข้าใจความหมายดังนั้น ทบวงปรมาณูระหว่างประเทศ และองค์กรระหว่างประเทศว่าด้วยมาตรฐานได้ออกแบบสัญลักษณ์ใหม่เป็นรูปคลื่นของรังสีกะโหลกไขว้และคนกำลังวิ่งดังรูป
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสีเกิดจากการแตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มีขนาดเล็กแล้วได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่รวมทั้งมีพลังงานเกี่ยวข้องกับปฏิกิริยาเป็นจำนวนมหาศาลซึ่งสามารถนำมาใช้ประโยชน์ได้
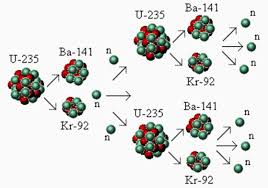
ในปีพศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียส U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า กระบวนการที่นิวเคลียสของไอโซโทปของธาตุบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่าดังตัวอย่างที่กล่าวมาแล้วเรียกว่า ฟิชชัน ไอโซโทปของธาตุอื่นที่สามารถเกิดฟิชชันได้ เช่น U-238 การเกิดฟิชชัน แต่ละครั้งจะคายพลังงานออกมาเป็นจำนวนมากและได้ไอโซโทปกัมมันตรังสีหลายชนิดซึ่งถือว่าได้เป็นวิธีผลิตไอโซโทปกัมมันตรังสีที่สำคัญนอกจากนี้ฟิสชั่นยังได้นิวตรอนเกิดขึ้นอีกด้วย ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นจะเกิดเป็นฟิชชันต่อเนื่องไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่
ฟิชชันที่เกิดภายในภาวะที่เหมาะสม จะได้จำนวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็วทำให้ฟิชชัน ดำเนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาเป็นจำนวนมหาศาลถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดรุนแรงหลักการเกิดปฏิกิริยาลูกโซ่ได้นำมาใช้ในการทำระเบิดปรมาณูการควบคุมฟิชชันทำได้หลายวิธี เช่นควบคุมมวลของสารตั้งต้นให้น้อยลงเพื่อให้จำนวนนิวตรอนที่เกิดมีไม่เพียงพอที่จะทำให้เกิดปฏิกิริยาลูกโซ่ได้ ในกรณีที่นิวเคลียสของธาตุเบา 2 ชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่า เดิมและให้พลังงานปริมาณมาก ปฏิกิริยานี้เรียกว่า ฟิวชัน ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยากับที่เกิดบนดวงอาทิตย์การเกิดฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมากและเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้าร่วมกันซึ่งประมาณว่าจะต้องมีอุณหภูมิสูงถึงหลายล้านองศาเซลเซียส พลังงานมหาศาลนี้อ่านได้จากฟิชชันซึ่งเปรียบเสมือนฉนวนที่ทำให้เกิดฟิวชั้น ถ้าพลังงานที่ปล่อยออกมามาจากฟิวชันเกิดขึ้นอย่างรวดเร็วจะเกิดการระเบิดอย่างรุนแรงแต่ถ้าควบคุมให้มีการปล่อยพลังงานออกมาอย่างช้าๆและต่อเนื่องจะให้พลังงานมหาศาลที่เป็นประโยชน์ต่อมนุษย์ฟิวชันมีข้อได้เปรียบมากกว่าฟิชชันหลายประการกล่าวคือคายพลังงานออกมาม่าสารตั้งต้นของฟิวชันหาได้ง่ายและมีปริมาณมากนอกจากนี้ผลิตภัณฑ์ที่เกิดจากฟิวชันเป็นธาตุกัมมันตรังสีที่มีครึ่งชีวิตสั้นและมีอันตรายน้อยกว่า ผลิตภัณฑ์จากการเกิดฟิชชัน แม้จะมีการค้นพบกระบวนการฟิวชั่นมานานแต่ การนำมาใช้อย่างเป็นรูปธรรม เป็นไปได้ยากเพราะการเกิดฟิวชั้นต้องใช้อุณหภูมิสูงมากซึ่งที่สภาวะนี้แสนจะเปลี่ยนเป็นรูป Plasma ซึ่งไม่เสถียรดังนั้นการควบคุมกระบวนการฟิวชันให้เกิดอย่างต่อเนื่องเป็นไปได้ยากมาก
2.6.6 เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
สารกัมมันตรังสีแต่ละชนิดมีครึ่งชีวิตไม่เท่ากันและแผ่รังสีได้แตกต่างกันการนำสารกัมมันตรังสีมาใช้ประโยชน์จึงแตกต่างกัน
ด้านธรณีวิทยา ใช้ C-14 ซึ่งมีครึ่งชีวิต 5730 ปีหาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบ เช่นไม้กระดูกการหาอายุโบราณโดยการวัดปริมาณของ C-14 อธิบายได้ว่าในบรรยากาศมี C-14 ซึ่งเกิดจากไนโตรเจนรวมตัวกับนิวตรอนจากรังสีคอสมิก
ด้านการแพทย์ ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่างๆในร่างกายโดยให้คนไข้รับประทานอาหารหรือยาที่มีไอโซโทปกัมมันตรังสีจำนวนเล็กน้อยจากนั้นใช้เครื่องมือตรวจสอบรังสีเพื่อติดตามดูผลการดูดซึมของไอโซโทปกัมมันตรังสีของระบบอวัยวะต่างๆ
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืชโดยเริ่มจากการดูดซึมที่รากจนถึงการคายออกที่ใบ หรือจำนวนแร่ธาตุที่พืชสะสมไว้ในใบ
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่างเช่นใช้ตรวจหารอยตำหนิในโลหะหรือรอยรั่วของท่อขนส่งของเหลวผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไปตามท่อและติดตามการแผ่รังสีด้วยเครื่องไกเกอร์ มึลเลอร์ เคาน์เตอร์ บริเวณใดที่มี สัญญาณจำนวนนับมากผิดปกติแสดงว่าบริเวณนั้นมีการรั่วไหลเกิดขึ้น
2.7 การนำภาพไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิตมนุษย์
มนษย์นำธาตุุมาใช้ประโยชน์ตั้งแต่อดีตกาลเช่นนำทองคำมาทำเป็นเครื่องประดับ นำเหล็กมาทำเป็นมีน้ำทองใดมาทำเป็นภาชนะหรือเครื่องใช้ ในปัจจุบันมีการค้นพบและศึกษาสมบัติของธาตุมากขึ้นจึงมีการนำธาตุมาใช้ประโยชน์ได้หลากหลายขึ้น
2.7.1 ประโยชน์ของธาตุ
การจำแนกธาตุออกเป็นกลุ่มนอกจากจะช่วยให้ง่ายต่อการศึกษาสมบัติของธาตุแล้วยังง่ายต่อการพิจารณาสมบัติที่เหมาะสมในการนำไปประยุกต์ใช้งานอีกด้วย
-ธาตุโลหะ มีสมบัติการนำความร้อนและไฟฟ้าได้ดีจึงนิยมนำมาเป็นอุปกรณ์นำไฟฟ้าเช่นนำทองแดงมาทำสายไฟน้ำสังกะสีมาทำขั้วไฟฟ้าของถ่านไฟฉาย
-ธาตุกึ่งโลหะ เช่นซิลิกอน เจอร์เมเนียม มีสมบัติก้ำกึ่งระหว่างโลหะกับโลหะ นำไฟฟ้าได้แต่นำไม่ดีนิยมนำมาทำเป็นสารกึ่งตัวนำ
-ธาตุหมู่ 18 เป็นธาตุที่เฉยต่อการเกิดปฏิกิริยาจึงนำมาใช้ประโยชน์ตามสมบัติของแก๊สมีสกุลเช่นนำ-ฮีเลียมซึ่งมีความหนาแน่นน้อยกว่าอากาศมาบรรจุในบอลลูนและเรือเหาะแทนแก๊สไฮโดรเจน
-ธาตุมีไอโซโทปกัมมันตรังสี สามารถนำมาใช้ประโยชน์ได้ดังที่กล่าวไว้ในหัวข้อ 2.6.6 และธาตุุที่อยู่กลุ่มเดียวกันจะมีสมบัติคล้ายกันแต่ถ้าชุดชนิดยังมีสมบัติเฉพาะตัวที่แตกต่างกันด้วยดังนั้นการนำไปใช้ประโยชน์จึงมีความจำเพาะแตกต่างกันการที่ธาตุแต่ละชนิดมีสมบัติเฉพาะตัวแตกต่างกันทำให้บางครั้งนักวิทยาศาสตร์ต้องนำธาตุมากกว่า 1 ชนิดมาละลายหรือผสมกันเพื่อให้มีสมบัติตามที่ต้องการและนำไปใช้ประโยชน์ได้หลากหลายมากขึ้น
2.7.2 ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม
จากความรู้เดิมโครงสร้างมาแล้วว่าธาตุบางชนิดส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อมเช่นตะกั่วได้ถูกใช้ในอุตสาหกรรมผลิตแบตเตอรี่ ล้วนส่งผลกระทบต่อสิ่งมีชีวิตเช่นถ้าตะกั่วปนเปื้อนในน้ำอาจจะส่งผลต่อการเจริญเติบพันธ์ระบบโลหิตและระบบประสาทของสัตว์ในแหล่งน้ำนั้นได้
ในหัวข้อที่ผ่านมานักเรียนได้ทราบแล้วว่าทอมสันค้นพบอิเล็กตรอนและค่าประจุต่อมวลในหัวข้อนี้นักเรียนจะได้รู้ เกี่ยวกับอนุภาคชนิดอื่นที่เป็นองค์ประกอบของอะตอม
2.2.1 อนุภาคในอะตอม
ในปีพ.ศ 2451 โรเบิร์ตแอนดรูส์มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยการอาศัยสังเกตหยดน้ำมันในสนามไฟฟ้าดังรูป
เมื่อไรน้ำมันที่ร่วงผ่านรูบนขั้วไฟฟ้าบวกกระทบรังสีจะมีประจุไฟฟ้าเกิดขึ้นทำให้ละอองน้ำมันบังหมดเคลื่อนที่เข้าหาขั้วไฟฟ้าบวกบางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าล็อคและปลดลอยนิ่งอยู่ระหว่างสนามไฟฟ้าขนาดของหยดน้ำมันที่ลอยนิ่งอยู่ระหว่างสนามไฟฟ้าสามารถสังเกตได้จากกล้องจุลทรรศน์และนำมาคำนวณหามวลของหยดน้ำมันที่สร้างความหนาแน่นของน้ำมันและจากความสำคัญของน้ำหนักของหยดน้ำมันที่ลอยนิ่งเท่ากับแรงที่เกิดจากสนามไฟฟ้าทำให้สามารถคำนวณค่าประจุไฟฟ้าบนหยดน้ำมันได้ ซึ่งพบว่าค่าประจุไฟฟ้าบนหยดน้ำมันมีค่าเป็นจำนวนเท่ากับ 1.60 × 10^-19 คูลอมบ์ มิลลิแกนจึงสรุปว่าประจุของอิเล็กตรอนมีค่าเท่ากับ 1.60 × 10^-19 คูลอมบ์ ไม่นำมาใช้คำนวณร่วมกับค่าประจุต่อมวลที่รายงานไว้โดยทอมสันจะได้หมดอิเล็กตรอนเท่ากับ 9.11 × 10^-28 กรัม
ในปีพศ. 2429 ออยเกนโกลด์ ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดแอโนดซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่าจะเกิดการเรืองแสงแสดงว่ามีรังสีจากแอโนดซึ่ง เรียกรังสีนี้ว่ารังสีแคแนลหรือรังสีแอโนดซึ่งมีประจุบวก
ออยเกนโกลด์ชไตน์ได้ทำการทดลองกับแก๊สหลายชนิดพบว่ารังสีเอกซ์มีค่าประจุต่อมวลไม่คงที่จนกระทั่งกลุ่มนักวิจัยนำทีมโดยรัฐศาสตร์และทอมสันได้ทำการศึกษาหล่อในลักษณะเดียวกันที่บรรจุแก๊สไฮโดรเจนทำให้ได้ข้อสรุปว่าอนุภาคบวกมีค่าประจุเท่ากับอิเล็กตรอนและหาค่ามวลของประจุได้เป็น 1.673 × 10^-24 กรัมซึ่งมากกว่ามวลอิเล็กตรอนประมาณ 1840 เท่าที่อนุภาคนี้ว่าโปรตอน
ในปีพศ 2475 เจมส์แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาเพลงอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเสี่ยงสูงทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกว่านิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอนการค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอมซึ่งคำว่ามีค่ามากกว่ามวลรวมของโปรตอนเสื้อผ้าคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วยประมวลของอะตอมมีค่า 12 หน่วยและมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกันดังนั้นอิเล็กตรอนโปรตอนและนิวตรอนจึงเป็นอนุภาคในอะตอมซึ่งอนุภาคแต่ละชนิดมีรายละเอียดดังนี้
2.2.2 เลขอะตอมเลขมวลและไอโซโทป
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอมและมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับจำนวนโปรตอนเคลื่อนที่อยู่รอบๆอะตอมของธาตุแต่ละชนิดมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่นตัวเลขที่แสดงจํานวนโปรตอน เรียกว่า เลขอะตอม และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมากดังนั้นเมื่อของอะตอมส่วนใหญ่จึงเป็นมวลของนิวเคลียสซึ่งประกอบด้วยโปรตอนและนิวตรอน ผลรวมของจำนวนโปรตอนและนิวตรอน ว่า เลขมวล สัญลักษณ์ที่แสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุเลขอะตอมและเลขมวลของอะตอมเรียกว่าสัญลักษณ์นิวเคลียส
อะตอมของธาตุชนิดเดียวกันมีจำนวนโปรตอนและอิเล็กตรอนเท่ากันแต่จำนวนนิวตรอนอาจมีได้หลายค่าทำให้อะตอมของธาตุเดียวกันมีมวลต่างกัน เฟรเดอริก ซอดดี นักเคมีชาวอังกฤษอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกันว่าไอโซโทป นอกจากนี้ยังมี ไอโซโทน ซึ่งหมายถึง ธาตุต่างชนิดกันแต่มีนิวตรอนเท่ากัน ไอโซบาร์ หมายถึง ธาตุต่างชนิดกันเลขมวลเท่ากันแต่ละอะตอมต่างกัน และไอโซอิเล็กทรอนิกส์ หมายถึง ธาตุหรือไอออนที่มีจำนวนอิเล็กตรอนเท่ากัน
2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
จากการศึกษาแบบจำลองอะตอมทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียสโดยอิเล็กตรอนเคลื่อนที่อยู่รอบรอบและอยู่ในระดับพลังงานต่างกันเล็กตอนเหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงานจะมีอิเล็กตรอนสูงสุดเท่าไหร่ให้พิจารณาข้อมูลแสดงการจัดเรียงอิเล็กตรอนของธาตุบางธาตุดังตาราง
เมื่อพิจารณาข้อมูลแล้วจะพบว่าจำนวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มากที่สุดคือ 2 อิเล็กตรอนระดับพลังงานที่ 2 มีได้มากที่สุดคือแบบอิเล็กตรอนสำหรับระดับพลังงานที่ 3 จากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีมากที่สุด 18 อิเล็กตรอนด้วยคือจำนวนอิเล็กตรอนมากที่สุดที่มีได้ในแต่ระดับพลังงานจะมีค่าเท่ากับ 2n^2 เมื่อ n คือตัวเลขแสดงระดับพลังงานถ้าพิจารณาตามหลัก 2n^2 การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 289 และจากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตามลำดับซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของธาตุทั้งสองมีเพียง 8 อิเล็กตรอนและอิเล็กตรอนที่เพิ่มมา 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18 อิเล็กตรอน
2.3.2 ระดับพลังงานหลักและระดับพลังงานย่อย
นักเรียนทราบมาแล้วว่าโบเสนอแบบจำลองโดยใช้ข้อมูลเกี่ยวกับเส้นสเปกตรัมของไฮโดรเจนซึ่งแสดงให้เห็นว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่างพลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากันโดยความแตกต่างของพลังงานจะมีค่าน้อยลงเมื่อระดับพลังงานสูงขึ้นการอธิบายเกี่ยวกับเส้นสเปกตรัมของโบว์ได้จุดประกายให้นักวิทยาศาสตร์หลายคนเกิดความสนใจและศึกษาเกี่ยวกับเส้นสเปกตรัมมากขึ้น และพบว่าเส้นสเปกตรัมของไฮโดรเจนที่เปล่งแสงออกมาและมองเห็นเป็นหนึ่งเส้นแท้จริงนั้นประกอบด้วยเส้นสเปกตรัมมากกว่า 1 เส้นซึ่งนำไปสู่ข้อสรุปที่ว่าเส้นสเปกตรัมที่เกิดขึ้นนอกจากเป็นการคายพลังงานของอิเล็กตรอนจากระดับพลังงานหลักซึ่งแทนด้วย n แล้วยังเป็นการ พลังงานของอิเล็กตรอนจากระดับพลังงานย่อยของแต่ละระดับพลังงานหลักอีกด้วยนักวิทยาศาสตร์ได้กำหนดระดับพลังงานย่อยเป็นตัวอักษร s p d และ f ตามลำดับ
ระดับพลังงานที่ 1 (n = ) มี 1 ระดับพลังงานย่อยคือ s ระดับพลังงานหลักที่ 2 (n = 2) มี 2 ระดับพลังงานย่อยคือ s p ระดับพลังงานที่ 3 (n = 3) มี 3 ระดับพลังงานย่อยคือ s p d และระดับพลังงานหลักที่ 4 (n = 4) มี 4 ระดับพลังงานย่อยคือ s p d f
2.3.3 ออร์บิทัล
อิเล็กตรอนมีการเคลื่อนที่ตลอดเวลาความหนาแน่นของกลุ่มหมอกอิเล็กตรอน ซึ่งอยู่ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกันบริเวณรอบนิวเคลียสซึ่งมีโอกาสที่จะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่าออเรนทอลการศึกษา พบว่าจำนวนออร์บิทัลในแต่ละพลังงานย่อยมีค่าแตกต่างกันซึ่งสรุปได้ดังนี้ระดับพลังงานย่อย s มี 1 ออร์บิทัล ระดับพลังงานย่อย p มี 3 ออร์บิทัล ระดับพลังงานย่อยดีมี 5 ออร์บิทัล รอบพลังงานย่อย f มี 7 ออร์บิทัล
อิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมเรียกว่า เวเลนซ์อิเล็กตรอน การบรรจุอิเล็กตรอน ตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลัก อาฟบาว ดังที่กล่าวมาแล้ว มีบางธาตุที่การบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่ได้เป็นไปตามหลักการนั้น เช่น Cr มีเลขอะตอม 24 Cu มีเลขอะตอม 29
ธาตุที่ได้รับหรือเสียอิเล็กตรอน สามารถเขียนการจัดเรียงอิเล็กตรอนได้ดังนี้ 1.กรณีที่ถ้าได้รับอิเล็กตรอน ให้บรรจุอิเล็กตรอนปกติรวมกับอิเล็กตรอนที่รับเข้ามาตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลัก อาฟบาว 2.กรณีที่ถ้าเสียอิเล็กตรอนให้บรรจุอิเล็กตรอน ตามปกติก่อนจากนั้นจึงนำอิเล็กตรอนที่อยู่ชั้นนอกสุดออก
2.4 ตารางธาตุและสมบัติของธาตุหมู่หลัก
ปัจจุบันนักวิทยาศาสตร์ได้ค้นพบธาตุแล้วเป็นจำนวนมากถ้าเรานั้นอาจมีสมบัติบางประการคล้ายกัน และบางประการแตกต่างกันจึงยากที่จะจดจำสมบัติต่างๆของแต่ละธาตุได้ทั้งหมดนักวิทยาศาสตร์จึงหาเกณฑ์ในการจัดธาตุที่มีสมบัติคล้ายการให้อยู่ในกลุ่มเดียวกันเพื่อง่ายต่อการศึกษา
2.4.1 วิวัฒนาการของตารางธาตุ
เมื่อมีการค้นพบธาตุและศึกษาสมบัติของธาตุเหล่านี้แล้วเราวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆ ของธาตุและนำมาใช้จัดตารางธาตุเป็นกลุ่มได้หลายแบบ
ในปีพศ. 2360 โยฮันน์เดอเบอไรเนอร์ เต้นนักเคมีคนแรกที่พยายามจัดตารางธาตุเป็นกลุ่มกลุ่มกลุ่มละ 3 ช่าตอนสมบัติที่คล้ายคลึงกันเรียกว่าชุดสาม โดยพบว่าท่าทางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีก 2 ธาตุที่เหลือ ดังรูป
ในปีพ. ศ. 2427 จอห์นนิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษได้เสนอในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียนต่างชาติหมดอะตอมจากน้อยไปมากพบว่าถ้าที่ 8 จะมีสมบัติเหมือนท่าที่หนึ่งเสมอ โดยไม่รวมค่าไฮโดรเจนและแก๊สมีสกุล การจัดเรียงธาตุตามแนวคิดของนิวตันใช้ได้ถึงธาตุแคลเซียมเท่านั้นกดนี้ไม่สามารถอธิบายได้เพราะว่า เหตุใดมวลอะตอมจึงเกี่ยวข้องกับสมบัติที่คล้ายคลึงกันของธาตุทำให้ไม่เป็นที่ยอมรับในเวลาต่อมา ดังรูป
ในปีพศ 2412 ยูลิอุส โลทาร์ ไมเออร์ นักวิทยาศาสตร์ชาวเยอรมันและ ดิมิทรี เมนเดเลเอฟ นักวิทยาศาสตร์ชาวรัสเซียศึกษารายละเอียด ของทอดต่างๆมากขึ้นทำให้มีข้อสังเกตว่าถ้าท่านเองตามมวลอะตอมจากน้อยไปมากจะพบว่าท่านมีสมบัติคล้ายกันเป็นช่วงช่วงการที่ธาตุต่างๆมีสมบัติคล้ายกันเป็นช่วงช่วงเช่นนี้ จึงต้องเป็นกรดเรียกว่ากฎพิริออดิก การจัดธาตุเป็นหมวดหมู่ของเมนเดเลเอฟ ไม่ได้หยุดการเรียงลำดับตามมวลอะตอมจากน้อยไปมากเพียงอย่างเดียวแต่ได้นำสมบัติที่คล้ายคลึงกันของธาตุที่ปรากฏซ้ำกันเป็นช่วงๆมาพิจารณาด้วยนอกจากนี้ยังได้เว้นช่องว่างไว้โดยคิดว่าน่าจะเป็นตำแหน่งของธาตุที่ยังไม่ได้มีการค้นพบโดยที่ตำแหน่งของธาตุในตารางธาตุมีความสัมพันธ์ กับสมบัติของธาตุเมนเดเลเอฟ จึงได้ทำนายสมบัติของธาตุ ที่ยังไม่ได้มีการค้นพบ 3 ธาตุและให้ชื่อว่า เอคา-โบรอน เอคา-อะลูมิเนียม และ เอคา-ซิลิกอน ในเวลาต่อมา ก็ได้ค้นพบธาตุสแกนเดียม แกลเลียม และเจอร์เมเนียมตามลำดับ ซึ่งสมบัติใกล้เคียงกับที่ได้ทำนายไว้
ในปีพ. ศ. 2456 เฮนรี โมสลีย์ นักวิทยาศาสตร์ชาวอังกฤษ เสนอให้จัด ธาตุเรียงตามเลขอะตอม เนื่องจากสมบัติต่างๆของธาตุมีความสัมพันธ์กับประจุบวกในนิวเคลียสหรือเลขอะตอมมากกว่ามวลอะตอม ตารางธาตุในปัจจุบันจึงได้ปรับปรุงมาจากตารางธาตุของเมนเดเลเอฟแต่เรียงธาตุตามเลขอะตอมจากน้อยไปมาก ดังรูป
แบ่งธาตุในแนวตั้งเป็น 18 แถวโดยเรียกแถวในแนวตั้งว่าหมู่และแบ่งธาตุในแนวนอนเป็น 7 แถวโดยเรียกแถวในแนวนอนว่าคาบ
2.4.2 กลุ่มของธาตุในตารางธาตุ
การที่นักวิทยาศาสตร์จัดธาตุในตารางธาตุเป็นหมู่และคาบเพื่อให้ง่ายต่อการศึกษาสมบัติของธาตุต่างๆถ้าแบ่งกลุ่มของธาตุตามสมบัติความเป็นโลหะจะแบ่งได้ 3 กลุ่มคือธาตุโลหะเป็นธาตุที่นำไฟฟ้าและความร้อนได้ดีธาตุกึ่งโลหะเป็นธาตุที่นำไฟฟ้าได้ไม่ดีที่อุณหภูมิห้องจะจะนำไฟฟ้าได้ดีเมื่ออุณหภูมิสูงขึ้นและธาตุอโลหะซึ่งเป็นธาตุที่ไม่นำไฟฟ้าเลยยกเว้นคาร์บอนและฟอสฟอรัสดำเมื่อพิจารณาตำแหน่งของธาตุพบว่าธาตุโลหะอยู่ทางซ้ายมือของตารางธาตุ ธาตุอโลหะจะอยู่บริเวณที่เป็นขั้นบันไดและธาตุอโลหะจะอยู่ขวามือของตารางธาตุยกเว้นไฮโดรเจนอยู่ทางซ้ายมือของตารางธาตุ
ถ้าแบ่งกลุ่มธาตุในตารางธาตุโดยพิจารณาการจัดเรียงอิเล็กตรอน ในออร์บิทัล s p d f ที่มีพลังงานสูงสุด และมีอิเล็กตรอนบรรจุอยู่จะแบ่งธาตุได้เป็น 4 กลุ่มใหญ่คือถ้ากลุ่ม s ได้แก่ธาตุในหมู่ที่ 1 และ 2 ธาตุกลุ่ม p ได้แก่ธาตุในหมู่ที่ 13 ถึง 18 ยกเว้นฮีเลียมธาตุกลุ่มดีได้แก่ธาตุในหมู่ที่ 3 ถึง 12 ส่วนธาตุในกลุ่ม f ได้แก่กลุ่มธาตุที่อยู่ด้านล่างของตารางธาตุที่นิยมมาจากหมู่ 3 คาบที่ 6 และ 7
ธาตุกลุ่ม s และธาตุกลุ่ม p เรียกรวมกันว่า ถ้ากลุ่ม a ซึ่งเป็นกลุ่มของธาตุเรพรีเซนเททีฟ หรืออาจเรียก กลุ่มธาตุหมู่หลัก เมื่อพิจารณาการจัดเรียงอิเล็กตรอนของธาตุกลุ่มเอพบว่าถ้าในแนวตั้งที่อยู่ในกลุ่มเอจะมีเวเลนซ์อิเล็กตรอนและจำนวนเวเลนซ์อิเล็กตรอน เท่ากัน จะตรงกับเลขหมู่ธาตุบางหมู่มีการกำหนดชื่อที่เป็นสากลเช่น 5 หมู่ IA มีชื่อเรียกว่าโลหะแอลคาไล ธาตุหมู่ IIA มีชื่อเรียกว่าโลหะแอลคาไลน์เอิร์ท ธาตุหมู่ VIIA มีชื่อเรียกว่า ธาตุแฮโลเจน และธาตุหมู่ VIIIA ยกเว้น Og เรียกว่าแก๊สมีสกุล กลุ่ม d และ f เรียกรวมกันว่าธาตุกลุ่ม B หรือกลุ่มแทรนซิชัน ซึ่งแบ่งเป็นทรานซิชันชั้นนอกและธาตุแทรนซิชันชั้นในได้แก่กลุ่ม d และ f ตามลำดับ ยังสามารถแบ่งได้เป็น 2 กลุ่มย่อยกลุ่มได้อยู่คาบที่ 6 และมีเลขอะตอมตั้งแต่ 57 ถึง 71 เมื่อกลุ่มนี้ว่าแลนทานอยด์ กลุ่มที่ 2 อยู่คาบที่ 7 และมีเลขอะตอมตั้งแต่ 89 ถึง 130 กลุ่มนี้ว่ากลุ่มธาตุแอกทินอยด์ เมื่อพิจารณา การจัดเรียงอิเล็กตรอนของธาตุแทรนซิชันพบว่าจำนวนเวเลนซ์อิเล็กตรอนส่วนใหญ่เท่ากับ 2 เมื่อพิจารณาธาตุกลุ่มนี้ตามแนวนอนพบว่าจำนวนระดับพลังงานจะตรงกับเลขที่คาบเช่นเดียวกับธาตุในกลุ่มธาตุหมู่หลัก จากการศึกษาการจัดเรียงธาตุในตารางธาตุช่วยให้ทราบถึงตารางธาตุในปัจจุบันจัดธาตุเป็นหมู่และคาบโดยอาศัยสมบัติบางประการที่คล้ายกันสมบัติของธาตุหมู่หลักตามหมู่และตามคาบซึ่งได้แก่ขนาดอะตอม รัศมีไอออน พลังงานไอออไนเซชัน อิเล็กโทรเนกาติวิตี สัมพันธภาพอิเล็กตรอน
2.4.3 ขนาดอะตอม
ตามแบบจำลองอะตอมแบบกลุ่มหมอกอิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลาด้วยความเร็วสูงและไม่สามารถบอกตำแหน่งที่แน่นอนรวมทั้งไม่สามารถกำหนดขอบเขตที่แน่นอนของอิเล็กตรอนได้นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดียวแต่จะมีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันถึงเป็นเรื่องยากที่จะวัดขนาดอะตอมที่อยู่ในสภาวะอิสระหรือเป็นอะตอมเดี่ยวในทางปฏิบัติจึงบอกขนาดอะตอมด้วยรัศมีอะตอมซึ่งกำหนดให้มีค่าเท่ากับครึ่งหนึ่งของระยะทางระหว่างนิวเคลียสของอะตอมทั้ง 2 ที่มีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน เพื่อศึกษา รัศมีอะตอมของธาตุทำให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้ดังรูป
เมื่อพิจารณาขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันพบว่า ขนาดอะตอมมีแนวโน้มลดลงหมายเลขอะตอมเพิ่มขึ้นอธิบายได้ว่าเนื่องจากธาตุในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนอยู่ในระดับพลังงานเดียวกันแต่มีจำนวนโปรตอนในนิวเคลียสต่างกันเท่าที่มีจำนวนโปรตอนมากจะดึงดูดเวเลนซ์อิเล็กตรอนด้วยอะไรที่มากกว่าธาตุที่มีจำนวนโปรตอนน้อยเวเลนซ์อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากกว่าทำให้อิเล็กตรอนมีขนาดเล็กลงส่วนธาตุในหมู่เดียวกันเมื่อใดอะตอมเพิ่มขึ้นจำนวนโปรตอนในนิวเคลียสและจำนวนระดับพลังงานที่มีต่ออีก 1 ตอนเพิ่มขึ้นด้วยอิเล็กตรอนที่อยู่ในชั้นในจึงเป็นคล้ายฉากกั้นแรงดึงดูดระหว่างโปรตอนในนิวเคลียสกับเวเลนซ์อิเล็กตรอนทำให้แรงดึงดูดต่อ เวเลนซ์อิเล็กตรอน มีน้อยเป็นผลให้ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม
2.4.4 ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอนเมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออนการบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดของอะตอม กล่าวคือ จะบอกเป็นค่ารัศมีไอออนซึ่งพิจารณาจากระยะทางระหว่างนิวเคลียสของไอออนคู่หนึ่งหนึ่งที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
เมื่อโลหะ ทำปฏิกิริยากับอโลหะอะตอมของโลหะจะเสียเวลาแต่เล็กจนกลายเป็นไอออนบวกจำนวนอิเล็กตรอนในอะตอมจึงลดลงทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วยหรือกล่าวอีกนัยหนึ่งก็คือแรงดึงดูดระหว่าง ประจุในนิวเคลียสกับอิเล็กตรอนจากเพิ่มมากขึ้น Iron ห่วงจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบเนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิมไอออนลบจึงมีขนาดใหญ่กว่าอะตอมเดิม ดังรูป
พลังงานปริมาณน้อยที่สุดที่ทำให้อิเล็กตรอนหลุดจากอะตอมในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชัน โดยค่า IE แสดงถึงความยากง่ายในการทำให้ อะตอมในสถานะแก๊สกลายเป็นไอออนบวก โดยอีน้อยแสดงว่าทำให้เป็นไอออนบวกได้ง่ายแต่ถ้า IE มากแสดงว่าทำให้เป็นไอออนบวกได้ยากก็ทำให้ไฮโดรเจนอะตอมในสถานะแก๊สกลายเป็นไรโดยเช่นไอออนและสถานะแก๊สเขียนได้ดังนี้
H(g) ----> H^+(g) + e^-
การทำให้อิเล็กตรอนหลุดออกจากอะตอมของไฮโดรเจนจะต้องใช้พลังงานอย่างน้อยที่สุด 1318 กิโลจูลต่อโมล นั่นคือ พลังงานไอออไนเซชันของไฮโดรเจนอะตอมเท่ากับ 1318 กิโลจูลต่อโมล ธาตุไฮโดรเจน มี 1 อิเล็กตรอนจึงมีค่าพลังงานไอออไนเซชันเพียงค่าเดียวถ้าธาตุที่มีหลายอิเล็กตรอน ก็จะมีพลังงานไอออไนเซชันหลายค่าพลังงานที่น้อยที่สุดที่ทำให้อิเล็กตรอนตัวแรกหลุดออกมาจากอะตอม ที่อยู่ในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชันลำดับที่ 1 เขียนย่อเป็น IE 1 พลังงานที่ทำให้อิเล็กตรอนในลำดับต่อๆมาหลุดออกมาจากอะตอมเรียกว่าพลังงานไอออไนเซชันลำดับที่ 2 3 ... และเขียนย่อเป็น IE 2 IE 3 ตามลำดับ2.4.6 สัมพรรคภาพอิเล็กตรอน
พลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอนเลขว่าสัมพรรคภาพอิเล็กตรอนเขียนสมการการเปลี่ยนแปลงได้ดังนี้
A(g) + e^- ---> A^-(g)
หาค่าสัมพรรคภาพอิเล็กตรอน มีค่าเป็นบวกหมายความว่าอะตอมคายพลังงานเมื่อได้รับอิเล็กตรอนแสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดี ถ้าค่าสัมพรรคภาพอิเล็กตรอนเป็นลบแปลว่าต้องใช้พลังงานเพิ่มเข้าไปเพื่อให้และรับอิเล็กตรอนได้เพิ่มขึ้น 1 อิเล็กตรอน เมื่อพิจารณาตามข้อพบว่าค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะยกเว้น หมู่ VIIIA มีค่ามากกว่าธาตุโลหะแสดงว่าธาตุอโลหะมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดีกว่าถ้าโลหะเมื่อพิจารณาโดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มในการรับอิเล็กตรอนได้ดีกว่าท่านผู้อื่นที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่นี้จะทำให้มีอะตอมที่มีการจัดเรียงอิเล็กตรอนของธาตุหมู่ VIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตีความสามารถของอะตอมในการดึงดูดอีเล็คตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสารแนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางเป็นดังนี้
เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอมเนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุดและหมู่ VIIA มีขนาดเล็กที่สุด ความสามารถในการดึงดูดอีเล็คตรอนตามข้ามจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุดควรธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุดธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตี ลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดของอะตอมที่เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง
สมบัติของธาตุหมู่ A มาแล้วต่อไปจะได้ศึกษาธาตุอีกกลุ่มหนึ่งซึ่งอยู่ระหว่างธาตุหมู่ IA และหมู่ IIIA ที่เรียกว่าถ้าแทรนซิชันประกอบด้วยธาตุหมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มธาตุแลนทานอยด์และแอกทินอยด์
ธาตุแทรนซิชันเหล่านี้มีอยู่ในธรรมชาติและได้จากการสังเคราะห์บ้างถ้าเป็นธาตุกัมมันตรังสี
2.5.1 สมบัติของธาตุแทรนซิชัน
2.5.1 สมบัติของธาตุแทรนซิชัน
จากตาราง พบว่าธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะหมู่หลักในคาบเดียวกันเช่นมีพลังงานไอออไนเซชันลำดับที่ 1 และค่าอิเล็กโทรเนกาติวิตีต่ำอย่างไรก็ตามธาตุแทรนซิชันซึ่งมีจุดหลอมเหลวจุดเดือดและความหนาแน่นสูงกว่าโลหะหมูน่ะ เมื่อพิจารณาขนาดอะตอมพบว่าถ้าธาตุแทรนซิชันมีขนาดใกล้เคียงกันและมีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียมเพื่ออธิบายเกี่ยวกับขนาดอะตอมของธาตุแทรนซิชันให้พิจารณาการจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียมแคลเซียมและธาตุแทรนซิชันในคาบที่ 4 ดังตารางต่อไปนี้
จากตารางจะเห็นได้ว่าธาตุแทรนซิชันในคาบที่ 4 ส่วนใหญ่มีจำนวนเวเลนซ์อิเล็กตรอนเป็น 2 และมีจำนวนอิเล็กตรอนในระดับพลังงานย่อยที่อยู่ถัดจากระดับพลังงานนอกสุดเข้าไปไม่เท่ากันเนื่องจากอิเล็กตรอนตัวสุดท้ายบรรจุอยู่ในระดับพลังงานย่อย 3d
2.6 ธาตุกัมมันตรังสี
ถ้ามีกลุ่มหนึ่งในตารางธาตุซึ่งมีสมบัติแตกต่างจากที่เคยศึกษามาแล้วคือสามารถแผ่รังสีแล้วกลายเป็นอะตอมของธาตุใหม่ได้ ในปีพศ. 2439 อองตวนอองรีแบ็กเกอแรล นักวิทยาศาสตร์ชาวฝรั่งเศสพบว่าเมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำไว้กับสารประกอบของยูเรเนียม แผ่นฟิล์มจะมีลักษณะเหมือนถูกแสงและเมื่อทำการทดลองกับสารประกอบของยูเรเนียมชนิดอื่นๆก็ได้ผลเช่นเดียวกันจึงสรุปว่าน่าจะมีรังสีแพรออกมาจากธาตุยูเรเนียมต่อมาปีแอร์ กูรี และมารีกูรี ได้ค้นพบว่า ธาตุพอโลเนียมเรเดียมและทอเรียม ก็สามารถ รังสีได้เช่นเดียวกันปรากฏการณ์ที่ธาตุแพ้รังสีเองได้อย่างต่อเนื่องเรียกว่ากัมมันตภาพรังสี ซึ่งเป็นการเปลี่ยนแปลงภายในนิวเคลียส ของไอโซโทปที่ไม่เสถียรและไอโซโทปของธาตุที่สามารถแผ่รังสีเองได้อย่างต่อเนื่องเรียกว่าไอโซโทปกัมมันตรังสีหรือสารกัมมันตรังสี
2.6.1 การเกิดกัมมันตภาพรังสี
การเกิดกัมมันตภาพรังสีเป็นปรากฏการณ์ที่เกิดกับไอโซโทปกัมมันตรังสีเพราะนิวเคลียสมีพลังงานสูงมากและไม่เสถียรจึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสีจากการศึกษานักวิทยาศาสตร์แสดงให้เห็นว่ารังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีอาจเป็นรังสีแอลฟาบีตาหรือแกมมาสมบัติของรังสีบางชนิด
2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
จากการศึกษาไอโซโทป ของธาตุจำนวนมากทำให้ได้ข้อสังเกตว่า ไอโซโทปของนิวเคลียสที่มีอัตราส่วนระหว่างจำนวนนิวตรอนต่อจำนวนโปรตอนไม่เหมาะสมคือนิวเคลียสที่มีจำนวนนิวตรอนแตกต่างจากจำนวนโปรตอนมากเกินไปและจะไม่เสถียรจึงเกิดการเปลี่ยนแปลงภายในนิวเคลียสโดยการแผ่รังสีออกมาแล้วเกิดเป็นนิวเคลียสของธาตุใหม่ที่เสถียรกว่า
การแผ่รังสีบีตา เกิดกับนิวเคลียสที่มีจำนวนนิวตรอนมากกว่าโปรตอนมาก นิวตรอนในนิวเคลียสจะเปลี่ยนไปเป็นโปรตอนและอิเล็กตรอนซึ่งอิเล็กตรอนจะถูกปลดปล่อยออกจากนิวเคลียสในรูปของรังสีบีตาและนิวเคลียสใหม่จะมีเลขอะตอมเพิ่มขึ้น 1 โดยมวลยังคงเดิม
การแผ่รังสีแกมมา เกี่ยวกับไอโซโทปกัมมันตรังสีที่มีพลังงานสูงมากหรือไอโซโทปที่สลายตัวให้รังสีแอลฟาหรือบีตา แต่นิวเคลียสที่เกิดใหม่ยังไม่เสถียรเพราะมีพลังงานสูงจึงเกิดการเปลี่ยนแปลงให้มีพลังงานต่ำลงโดยปล่อยพลังงานส่วนเกินออกมาเป็นรังสีแกมมา
การแผ่รังสีแอลฟา ส่วนใหญ่เกิดจากนิวเคลียสที่มีเลขอะตอมสูงกว่า 83 และมีจำนวนนิวตรอนต่อโปรตอนในสัดส่วนที่ไม่เหมาะสม เมื่อปล่อยรังสีแอลฟาออกมา จะกลายเป็นนิวเคลียสของธาตุใหม่ที่เสถียรซึ่งมีเลขอะตอมลดลง 2 และเลขมวลลดลง
2.6.3 อันตรายจากไอโซโทปกัมมันตรังสี
กิจวัตรต่างๆในชีวิตประจำวันทั้งการรับประทานอาหารดื่มน้ำหายใจด้วยมีโอกาสที่มนุษย์จะได้รับรังสีจากไอโซโทปกัมมันตรังสีเข้าสู่ร่างกายนอกจากนี้ยังได้รับรังสีคอสมิกซึ่งเป็นรังสีที่ส่วนใหญ่มาจากอวกาศและสิ่งต่างๆเหล่านี้มีแหล่งกำเนิดจากธรรมชาตินอกจากนี้บางคนยังได้รับรังสีที่มนุษย์สร้างขึ้นมาเช่นรังสีจากโรงไฟฟ้านิวเคลียร์ แม้มนุษย์จะได้รับรังสีจากกิจวัตรประจำวันแต่การได้รับรังสีจากธรรมชาติหรือจากที่มนุษย์สร้างขึ้นในปริมาณเพียงเล็กน้อยโดยน้อยกว่า 100 มิลลิซีเวิร์ต เซลล์เนื้อเยื่อ สามารถฟื้นตัวได้แต่การได้รับรังสีมากกว่า 100 มิลลิซีเวิร์ต ทำให้เกิดความเสี่ยงต่อสุขภาพได้ เช่นการคลื่นไส้ การอาเจียนอา การปวดหัว การเป็นมะเร็ง สำหรับหน่วยงานที่ทำงานเกี่ยวกับรังสีจะต้องแสดงสัญลักษณ์รังสีลงบนฉลาก ของพันชนะหรือเครื่องมือ รวมทั้งบริเวณใกล้เคียงเพื่อให้ผู้พบเห็นได้ระมัดระวัง สัญลักษณ์รังสีใช้เป็นมาตรฐานจะได้รูปใบพัด 3 แฉกมีสีม่วงอ่อนม่วงเข้มหรือสีดำบนพื้นสีเหลืองดังรูป
เนื่องจากสัญลักษณ์รังสีดังรูปสื่อความหมายไม่ได้ชัดเจนหรือบุคคลที่ไม่เกี่ยวข้องอ่านไม่เข้าใจความหมายดังนั้น ทบวงปรมาณูระหว่างประเทศ และองค์กรระหว่างประเทศว่าด้วยมาตรฐานได้ออกแบบสัญลักษณ์ใหม่เป็นรูปคลื่นของรังสีกะโหลกไขว้และคนกำลังวิ่งดังรูป
2.6.4 ครึ่งชีวิตของไอโซโทปกัมมันตรังสีไอโซโทป
กัมมันตรังสีจะสลายตัวให้รังสีชนิดใดชนิดหนึ่งออกมาได้เองตลอดเวลาไอโซโทปกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกันอัตราการสลายตัวของไอโซโทปกัมมันตรังสีจะบอกเป็นครึ่งชีวิตใช้สัญลักษณ์ t1/2 โดยหมายถึงระยะเวลาที่นิวเคลียสของไอโซโทปกัมมันตรังสีสลายตัว จนเหลือครึ่งหนึ่งของปริมาณเดิมไอโซโทปกัมมันตรังสีของธาตุชนิดหนึ่งหนึ่งจะมีครึ่งชีวิตคงเดิมไม่ว่าจะอยู่ในรูปของธาตุหรือเกิดเป็นสารประกอบ ตัวอย่างดังรูป
โดยสูตรการคำนวณครึ่งชีวิต มีดังนี้
Nเหลือ = Nเริ่มต้น/2n
T = nt1/2
โดย Nเหลือ แทนปริมาณกัมตรังสีที่เหลือ
T แทนจำนวนเวลาที่ธาตุสลายตัว
Nเริ่มต้น แทนปริมาณกับมมันตรังสีเริ่มต้น
n แทนจำนวนครั้งในการสลายตัวของครึ่งชีวิต
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสีเกิดจากการแตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มีขนาดเล็กแล้วได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่รวมทั้งมีพลังงานเกี่ยวข้องกับปฏิกิริยาเป็นจำนวนมหาศาลซึ่งสามารถนำมาใช้ประโยชน์ได้
ในปีพศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียส U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า กระบวนการที่นิวเคลียสของไอโซโทปของธาตุบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่าดังตัวอย่างที่กล่าวมาแล้วเรียกว่า ฟิชชัน ไอโซโทปของธาตุอื่นที่สามารถเกิดฟิชชันได้ เช่น U-238 การเกิดฟิชชัน แต่ละครั้งจะคายพลังงานออกมาเป็นจำนวนมากและได้ไอโซโทปกัมมันตรังสีหลายชนิดซึ่งถือว่าได้เป็นวิธีผลิตไอโซโทปกัมมันตรังสีที่สำคัญนอกจากนี้ฟิสชั่นยังได้นิวตรอนเกิดขึ้นอีกด้วย ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นจะเกิดเป็นฟิชชันต่อเนื่องไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่
ฟิชชันที่เกิดภายในภาวะที่เหมาะสม จะได้จำนวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็วทำให้ฟิชชัน ดำเนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาเป็นจำนวนมหาศาลถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดรุนแรงหลักการเกิดปฏิกิริยาลูกโซ่ได้นำมาใช้ในการทำระเบิดปรมาณูการควบคุมฟิชชันทำได้หลายวิธี เช่นควบคุมมวลของสารตั้งต้นให้น้อยลงเพื่อให้จำนวนนิวตรอนที่เกิดมีไม่เพียงพอที่จะทำให้เกิดปฏิกิริยาลูกโซ่ได้ ในกรณีที่นิวเคลียสของธาตุเบา 2 ชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่า เดิมและให้พลังงานปริมาณมาก ปฏิกิริยานี้เรียกว่า ฟิวชัน ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยากับที่เกิดบนดวงอาทิตย์การเกิดฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมากและเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้าร่วมกันซึ่งประมาณว่าจะต้องมีอุณหภูมิสูงถึงหลายล้านองศาเซลเซียส พลังงานมหาศาลนี้อ่านได้จากฟิชชันซึ่งเปรียบเสมือนฉนวนที่ทำให้เกิดฟิวชั้น ถ้าพลังงานที่ปล่อยออกมามาจากฟิวชันเกิดขึ้นอย่างรวดเร็วจะเกิดการระเบิดอย่างรุนแรงแต่ถ้าควบคุมให้มีการปล่อยพลังงานออกมาอย่างช้าๆและต่อเนื่องจะให้พลังงานมหาศาลที่เป็นประโยชน์ต่อมนุษย์ฟิวชันมีข้อได้เปรียบมากกว่าฟิชชันหลายประการกล่าวคือคายพลังงานออกมาม่าสารตั้งต้นของฟิวชันหาได้ง่ายและมีปริมาณมากนอกจากนี้ผลิตภัณฑ์ที่เกิดจากฟิวชันเป็นธาตุกัมมันตรังสีที่มีครึ่งชีวิตสั้นและมีอันตรายน้อยกว่า ผลิตภัณฑ์จากการเกิดฟิชชัน แม้จะมีการค้นพบกระบวนการฟิวชั่นมานานแต่ การนำมาใช้อย่างเป็นรูปธรรม เป็นไปได้ยากเพราะการเกิดฟิวชั้นต้องใช้อุณหภูมิสูงมากซึ่งที่สภาวะนี้แสนจะเปลี่ยนเป็นรูป Plasma ซึ่งไม่เสถียรดังนั้นการควบคุมกระบวนการฟิวชันให้เกิดอย่างต่อเนื่องเป็นไปได้ยากมาก
2.6.6 เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
สารกัมมันตรังสีแต่ละชนิดมีครึ่งชีวิตไม่เท่ากันและแผ่รังสีได้แตกต่างกันการนำสารกัมมันตรังสีมาใช้ประโยชน์จึงแตกต่างกัน
ด้านธรณีวิทยา ใช้ C-14 ซึ่งมีครึ่งชีวิต 5730 ปีหาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบ เช่นไม้กระดูกการหาอายุโบราณโดยการวัดปริมาณของ C-14 อธิบายได้ว่าในบรรยากาศมี C-14 ซึ่งเกิดจากไนโตรเจนรวมตัวกับนิวตรอนจากรังสีคอสมิก
ด้านการแพทย์ ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่างๆในร่างกายโดยให้คนไข้รับประทานอาหารหรือยาที่มีไอโซโทปกัมมันตรังสีจำนวนเล็กน้อยจากนั้นใช้เครื่องมือตรวจสอบรังสีเพื่อติดตามดูผลการดูดซึมของไอโซโทปกัมมันตรังสีของระบบอวัยวะต่างๆ
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืชโดยเริ่มจากการดูดซึมที่รากจนถึงการคายออกที่ใบ หรือจำนวนแร่ธาตุที่พืชสะสมไว้ในใบ
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่างเช่นใช้ตรวจหารอยตำหนิในโลหะหรือรอยรั่วของท่อขนส่งของเหลวผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไปตามท่อและติดตามการแผ่รังสีด้วยเครื่องไกเกอร์ มึลเลอร์ เคาน์เตอร์ บริเวณใดที่มี สัญญาณจำนวนนับมากผิดปกติแสดงว่าบริเวณนั้นมีการรั่วไหลเกิดขึ้น
2.7 การนำภาพไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิตมนุษย์
มนษย์นำธาตุุมาใช้ประโยชน์ตั้งแต่อดีตกาลเช่นนำทองคำมาทำเป็นเครื่องประดับ นำเหล็กมาทำเป็นมีน้ำทองใดมาทำเป็นภาชนะหรือเครื่องใช้ ในปัจจุบันมีการค้นพบและศึกษาสมบัติของธาตุมากขึ้นจึงมีการนำธาตุมาใช้ประโยชน์ได้หลากหลายขึ้น
2.7.1 ประโยชน์ของธาตุ
การจำแนกธาตุออกเป็นกลุ่มนอกจากจะช่วยให้ง่ายต่อการศึกษาสมบัติของธาตุแล้วยังง่ายต่อการพิจารณาสมบัติที่เหมาะสมในการนำไปประยุกต์ใช้งานอีกด้วย
-ธาตุโลหะ มีสมบัติการนำความร้อนและไฟฟ้าได้ดีจึงนิยมนำมาเป็นอุปกรณ์นำไฟฟ้าเช่นนำทองแดงมาทำสายไฟน้ำสังกะสีมาทำขั้วไฟฟ้าของถ่านไฟฉาย
-ธาตุกึ่งโลหะ เช่นซิลิกอน เจอร์เมเนียม มีสมบัติก้ำกึ่งระหว่างโลหะกับโลหะ นำไฟฟ้าได้แต่นำไม่ดีนิยมนำมาทำเป็นสารกึ่งตัวนำ
-ธาตุหมู่ 18 เป็นธาตุที่เฉยต่อการเกิดปฏิกิริยาจึงนำมาใช้ประโยชน์ตามสมบัติของแก๊สมีสกุลเช่นนำ-ฮีเลียมซึ่งมีความหนาแน่นน้อยกว่าอากาศมาบรรจุในบอลลูนและเรือเหาะแทนแก๊สไฮโดรเจน
-ธาตุมีไอโซโทปกัมมันตรังสี สามารถนำมาใช้ประโยชน์ได้ดังที่กล่าวไว้ในหัวข้อ 2.6.6 และธาตุุที่อยู่กลุ่มเดียวกันจะมีสมบัติคล้ายกันแต่ถ้าชุดชนิดยังมีสมบัติเฉพาะตัวที่แตกต่างกันด้วยดังนั้นการนำไปใช้ประโยชน์จึงมีความจำเพาะแตกต่างกันการที่ธาตุแต่ละชนิดมีสมบัติเฉพาะตัวแตกต่างกันทำให้บางครั้งนักวิทยาศาสตร์ต้องนำธาตุมากกว่า 1 ชนิดมาละลายหรือผสมกันเพื่อให้มีสมบัติตามที่ต้องการและนำไปใช้ประโยชน์ได้หลากหลายมากขึ้น
2.7.2 ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม
จากความรู้เดิมโครงสร้างมาแล้วว่าธาตุบางชนิดส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อมเช่นตะกั่วได้ถูกใช้ในอุตสาหกรรมผลิตแบตเตอรี่ ล้วนส่งผลกระทบต่อสิ่งมีชีวิตเช่นถ้าตะกั่วปนเปื้อนในน้ำอาจจะส่งผลต่อการเจริญเติบพันธ์ระบบโลหิตและระบบประสาทของสัตว์ในแหล่งน้ำนั้นได้





























No comments:
Post a Comment